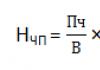Скорость химических реакций. Презентация по химии: «Скорость химических реакций Факторы, влияющие на скорость реакций
1 слайд
Тема урока: «Скорость химических реакций.» Цель урока: Знать определение скорости реагирующих веществ, от реакций; зависимости скорости от природы поверхности соприкосновения, от концентрации, от температуры, от катализатора. Уметь объяснять влияние различных условий на скорость химических реакций.

2 слайд
Для гомогенных реакций. Скорость химической реакции- это изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени ∆c V = ------------- ∆ т

3 слайд
Для гетерогенных реакций. Скорость определяется изменением количества вещества в единицу времени на единице поверхности твёрдого вещества.

4 слайд
Факторы, влияющие на скорость реакций. 1.Природа реагирующих веществ. 2.Концентрация веществ. 3.Площадь соприкосновения реагирующих веществ. 4.Температура. 5.Катализатор.

5 слайд
Природа реагирующих веществ 1)Взаимодействие Na и K с водой. 2)Взаимодействие галогенов с алюминием или водородом. Скорость приведённых ОВР зависит от электронной природы веществ. Объясните данную зависимость, применяя знания электронного строения атомов реагирующих веществ.

6 слайд
Концентрация веществ. (в растворённом или газообразном состоянии) 1)Горение серы на воздухе или в чистом кислороде. 2)Взаимодействие Zn c HCl разбавленной и концентрированной. Скорость реакции прямо пропорциональна концентрации реагирующих веществ. Объясните эту зависимость с т.зрения числа активных столкновений между молекулами.

7 слайд
Площадь поверхности соприкосновения реагирующих веществ. (для гетерогенных реакций) Пример: взаимодействие соляной кислоты с Zn в виде гранул и в виде порошка. Чем больше измельчено вещество, тем больше площадь соприкосновения реагирующих веществ и тем реакция идёт быстрее. Поверхность соприкосновения можно увеличить, применяя принцип « кипящего слоя» Объясните данные явления.
Химическая кинетика - один из сложных разделов химии. Данная презентация помогает обучающимся усвоить первичные понятия, систематизировать более сложный материал и потренироваться в решении типовых вопросов, входящих в систему ЕГЭ.
Скачать:
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
« C корость химических реакций». Тема урока:
Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакций.
Системы: Гомогенные (однородные) – системы, в которых не видна поверхность раздела между компонентами. Газовые смеси, растворы. Гетерогенные (неоднородные) – системы, в которых видна поверхность раздела между компонентами. Тв. в-во + тв. в-во, газ + тв. в-во, жидкость + тв. в-во.
Реакции: Гомогенные – реакции, протекающие в гомогенных системах. Протекают во всем объеме системы. Гетерогенные – реакции, протекающие в гетерогенных системах. Протекают на границе раздел фаз.
Скорость химической реакции - изменение концентрации одного из реагирующих веществ за единицу времени в единице объёма. + c 2 – c 1 + ∆c − t 2 – t 1 − ∆ t C – концентрация, в моль / л t – время, в секундах = = МОЛЬ Л ∙ С
Молярная концентрация – показывает количество молей вещества, находящееся в 1 литре. С = n / V [ C ] = [ моль/л ]
Задание 1. 1 .В сосуде объёмом 5 литров находится 1 моль водорода. Рассчитайте молярную концентрацию водорода. 2 . В растворе объёмом 2 л содержится 392 грамма серной кислоты. Рассчитайте молярную концентрацию раствора.
Изменение концентрации реагирующего вещества во времени С Концентрацця Время С 1 С 2 t 1 t 2 ∆ c ∆ t = ∆ c ∆ t
Факторы, влияющие на скорость реакции 1. Концентрация реагирующих веществ. 2.Температура. 3. Природа реагирующих веществ. 4. Площадь соприкосновения реагирующих веществ. 5. Катализатор.
Влияние концентрации реагирующих веществ на скорость реакции. Чем больше концентрация реагирующих веществ, тем чаще сталкиваются частицы веществ, а значит скорость реакции увеличивается.
Закон действия масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степени стехиометрических коэффициентов. Гульдберг, Вааге, 1867г.
m А + nB = A m B n = k ٠ С А m ٠ C B n k – константа скорости реакции: k = , при с А = с в = 1 моль/л при с А ٠ с в = 1 моль/л k – зависит от природы реагирующих веществ и от t
Запишите выражение ЗДМ для реакций: 2СО + О 2 = 2СО 2 N 2 + 3H 2 = 2NH 3 4P + 5O 2 = 2P 2 O 5 = k ٠ [ СО ] 2 ∙ [ О 2 ] = k ٠ ∙ 3 = k ٠ 5
Расчетные задачи: 2. Во сколько раз необходимо повысить давление в системе: N 2(г) + 3 H 2(г) 2 NH 3(г) , чтобы повысить скорость прямой реакции в 256 раз? В системе: 4NH 3(г) + 3O 2(г) 2N 2(г) + 6H 2 O (г) концентрацию аммиака повысили с 0,3 моль/л до 0,6 моль/л, а концентрацию кислорода понизили с 0,4 моль/л до 0,1 моль/л. Как изменилась скорость реакции?
Температура. Правило Вант-Гоффа: при повышении температуры на каждые 10 0 С скорость большинства реакций увеличивается в 2 – 4 раза. t 2 – t 1 10 Ү – температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при повышении t на 10 0 С. 2 = 1 ٠ Ү
Расчетные задачи: Как изменится скорость некоторой реакции при уменьшении температуры 30 0 С до 0 0 С, если температурный коэффициент равен 2? При температуре 20 0 С скорость реакции равна 2,7 моль/л.с. Чему равна скорость реакции при температуре 0 0 С, если температурный коэффициент равен 3?
Влияние температуры на скорость реакции. При повышении температуры, увеличивается скорость движения частиц, поэтому они чаще сталкиваются, а значит скорость реакции возрастает.
Влияние природы реагирующих веществ на скорость реакции. 2К+2Н 2 О=2КОН+Н 2 2Н 2 +О 2 =2Н 2 О
Влияние природы реагирующих веществ на скорость реакции. Са+2Н 2 О=Са(ОН) 2 +Н 2
Влияние природы реагирующих веществ на скорость реакции. Чем активнее вещество, тем скорость реакции с его участием больше.
Взаимодействие металлов с кислотами Zn + 2HCl = ZnCl 2 + H 2 1 Fe + 2HCl = FeCl 2 + H 2 2 Cu + 2HCl = реакция невозможна 1 > 2 Zn активнее Fe , а Cu малоактивный металл
Влияние площади соприкосновения реагирующих веществ на скорость реакции. 1. Скорость гетерогенных реакций зависит от площади соприкосновения веществ. 2. Гетерогенные реакции идут только на поверхности раздела реагирующих веществ. 3. Скорость гетерогенной реакции: ∆ n ∆ t ∙ S гетерог. =
Влияние площади соприкосновения реагирующих веществ на скорость реакции. Чем больше поверхность соприкосновения веществ, тем больше скорость реакции.
Влияние катализатора на скорость реакции. Катализаторами называются вещества, изменяющие скорость химических реакций. Химические реакции, протекающие при участии катализаторов, называют каталитическими. Сам катализатор в реакциях не расходуется и в конечные продукты не входит.
Влияние катализатора на скорость реакции. С 12 Н 22 О 11 + 12О 2 = 12СО 2 +11Н 2 О
Механизм каталитических реакций Для реакции: А + В = АВ Механизм: Катализатор взаимодействует с исходным веществом: А + К = АК Промежуточное соединение взаимодействует с другим исходным веществом: АК + В = АВ + К Суммарное уравнение: А + В = АВ
Как необходимо изменить условия в системе: 2 SO 2(г) + O 2(г) 2 SO 3(г) + Q , находящейся в равновесии, чтобы добиться максимальной концентрации оксида серы (IV)? Как сместится равновесие в системе: 2 H 2 S (г) + SO 2(г) 2 H 2 O (г) + 3 S (т) + Q , если: а) повысить температуру; б) понизить дав-ление; в) ввести катализатор; г) повысить концентрацию сероводорода; д) понизить концентрацию оксида серы (IV).
Домашнее задание: 1. Учить теорию и определения. 2. Письменно: О. стр 31 №48 записать выражение ЗДМ для реакций: 2 SO 2 + O 2 = 2SO 3 4NH 3 + 3O 2 = 2N 2 + 6H 2 O 4NH 3 + 5O 2 = 4NO + 6H 2 O 2H 2 O 2 = 2H 2 O + O 2 Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
ТЕМА УРОКА
«Скорость химических реакций. Факторы, влияющие на скорость химической реакции»

Выяснить, какие условия необходимо создать, чтобы началась химическая реакция;
научиться определять скорость химической реакции;
рассмотреть единицу измерения скорости химической реакции;
выяснить от каких факторов зависит скорость химических реакций.

ХИМИЧЕСКИЕ РЕАКЦИИ ПРОТЕКАЮТ С РАЗЛИЧНЫМИ СКОРОСТЯМИ
Мгновенно (при взрыве; в водных растворах, например, при смешивании растворов хлорида бария и сульфата натрия образуется сульфат бария в виде белого осадка);
- Быстро (растворение цинка в соляной кислоте; горение магния);
Медленно (образование ржавчины на железных предметах; окисление меди).

УСЛОВИЕ ВОЗНИКНОВЕНИЯ ХИМИЧЕСКОЙ РЕАКЦИИ
Соприкосновение веществ

ХИМИЧЕСКИЕ РЕАКЦИИ
Гетерогенные химические реакции
Гомогенные
химические
реакции

ГОМОГЕННЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ
Химические реакции, протекающие в однородной среде, например в растворе или газовой фазе, то взаимодействие реагирующих веществ происходит во всём объёме

ГЕТЕРОГЕННЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ
Если реакция идет между веществами, находящихся в разных агрегатных состояниях или между веществами, неспособными образовывать гомогенную среду (между несмешивающимися жидкостями), то она происходит только на поверхности соприкосновения веществ.

СКОРОСТЬ РЕАКЦИИ ОПРЕДЕЛЯЕТСЯ ИЗМЕНЕНИЕМ КОНЦЕНТРАЦИИ ВЕЩЕСТВА В ЕДИНИЦУ ВРЕМЕНИ.
В единице V (для гомогенной)
На единице поверхности соприкосновения веществ S (для гетерогенной)
n - изменение количества вещества (моль);
t– интервал времени (с, мин)
Изменение молярной концентрации;

АНАЛИЗ ТАБЛИЦЫ, ВЫВОДЫ:
Значение скорости реакции зависит от того, по какому веществу её определяют
Например, для реакции Н 2 +CI 2 = 2НCI
из 1 моль Н 2 образуется 2 моль НCI
скорость реакции увеличится в 2 раза (по изменению концентрации HCI)

ЗАДАЧА НА ПРИМЕНЕНИЕ ЗНАНИЙ ПО «СКОРОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ»
Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрация: вещества А – 0,80 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л.
Определите:
среднюю скорость реакции за этот промежуток времени;

САМОПРОВЕРКА.
Дано:
С (А) 1 = 0,80 моль/л
С (А) 2 = 0,74 моль/л
= 20 мин
Найти.
гомоген =?
Решение:
а) определение средней скорости реакции в растворе производится по формуле:
Ответ: гомоген. = 0,003 моль/л

ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Природа реагирующих веществ;
Температура;
Концентрация реагирующих веществ;
Действие катализаторов;
Поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Суть: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения , т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
энергией активации Е а.
ИЗМЕНЕНИЕ КОЛИЧЕСТВА ВЕЩЕСТВА, ПО КОТОРОМУ ОПРЕДЕЛЯЮТ СКОРОСТЬ РЕАКЦИИ – ВНЕШНИЙ ФАКТОР
Суть: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения , т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Е а.

1. ПРИРОДА РЕАГИРУЮЩИХ ВЕЩЕСТВ.
Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в неорганических и органических веществах.
Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
 120 Гидролиз сахарозы, взаимодействие металлов с кислотами, натрия с водой и спиртами, этилена с бромной водой и др. Незначительная Разложение аммиака на водород и азот, гидрирование этилена, окисление оксида серы (IV) до оксида серы (VI), разложение иодоводорода на иод и водород и др." width="640"
120 Гидролиз сахарозы, взаимодействие металлов с кислотами, натрия с водой и спиртами, этилена с бромной водой и др. Незначительная Разложение аммиака на водород и азот, гидрирование этилена, окисление оксида серы (IV) до оксида серы (VI), разложение иодоводорода на иод и водород и др." width="640"
Зависимость скорости реакции от природы реагирующих веществ.
Энергия активации Е а , кДж/моль
Скорость реакции
Примеры реакций
Очень большая
Средняя
Реакции ионного обмена между электролитами, взаимодействие щелочных металлов с кислородом и галогенами и др.
Гидролиз сахарозы, взаимодействие металлов с кислотами, натрия с водой и спиртами, этилена с бромной водой и др.
Незначительная
Разложение аммиака на водород и азот, гидрирование этилена, окисление оксида серы (IV) до оксида серы (VI), разложение иодоводорода на иод и водород и др.

ЗАДАНИЕ НА ПРИМЕНЕНИЕ ЗНАНИЙ
Объясните разную скорость взаимодействия цинка и магния с уксусной кислотой; цинка с соляной и уксусной кислотой.
Напишите соответствующие реакции

2. ТЕМПЕРАТУРА
При увеличении температуры на каждые 10° С скорость реакции увеличивается в 2-4 раза.
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:
где –скорость реакции при температуре t 2 ,
– скорость реакции при температуре t 1 ,
– температурный коэффициент.

ЗАДАЧА НА ПРИМЕНЕНИЕ ЗНАНИЙ:
Определите, как изменится скорость некоторой реакции:
при повышении температуры от 10° до 50° С;
Температурный коэффициент реакции равен 3.

САМОПРОВЕРКА
подставить данные задачи в формулу:
скорость реакции увеличится в 81 раз

3. КОНЦЕНТРАЦИЯ РЕАГИРУЮЩИХ ВЕЩЕСТВ.
На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг, и П Вааге и независимо от них в 1865 г. русский учёный Н.И. Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ:
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции.
Этот закон ещё называют
законом действующих масс.

МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ ЗАКОНА ДЕЙСТВУЮЩИХ МАСС.
По закону действующих масс скорость реакции, уравнение которой А+В=С может быть вычислена по формуле:
v 1 = k 1 C A C B ,
а скорость реакции, уравнение которой А+2В=D, может быть вычислена по формуле:
v 2 = k 2 C A C B .
В этих формулах: C A и C B – концентрации веществ А и В (моль/л), k 1 и k 2 – коэффициенты пропорциональности, называемые константами скоростей реакции . Эти формулы также называют кинетическими уравнениями.

ЗАДАЧА НА ПРИМЕНЕНИЕ ЗНАНИЙ:
1.Составьте кинетические уравнения для следующих реакций:
А) H 2 +I 2 =2HI;
Б) 2 Fe + 3CI 2 = 2 FeCI 3 .
2. Как изменится скорость реакции, имеющей кинетическое уравнение
концентрацию вещества А увеличить в 3 раза;

САМОПРОВЕРКА.
Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций.
скорость реакции увеличится в 9 раз.

4. ДЕЙСТВИЕ КАТАЛИЗАТОРА
Обсуждение вопросов:
1.Что такое катализатор и каталитические реакции?
2. Приведите примеры известных вам каталитических реакций из органической и неорганической химии. Укажите названия веществ – катализаторов.
3. Выскажите предположение о механизме действия катализаторов (на основе теории столкновений).
4. Каково значение каталитических реакций?

5.ПОВЕРХНОСТЬ СОПРИКОСНОВЕНИЯ РЕАГИРУЮЩИХ ВЕЩЕСТВ.
Скорость реакции увеличивается благодаря:
Увеличению площади поверхности соприкосновения реагентов (измельчение);
Повышению реакционной способности частиц на поверхности образующихся при измельчении микрокристаллов;
Непрерывному подводу реагентов и хорошему отводу продуктов с поверхности, где идёт реакция.
Фактор связан с гетерогенными реакциями, которые протекают на поверхности соприкосновения реагирующих веществ: газ - твердое вещество, газ - жидкость, жидкость - твердое вещество, жидкость - другая жидкость, твердое вещество - другое твердое вещество, при условии, что они не растворимы друг в друге.
Приведите примеры гетерогенных реакций.

ВЫВОДЫ ПО ТЕМЕ УРОКА
Химические реакции протекают с различными скоростями. Величина скорости реакции зависит от объёма в гомогенной системе и от площади соприкосновения реагентов – в гетерогенной.
На пути всех частиц, вступающих в химическую реакцию, имеется энергетический барьер, равный энергии активации Eа.
Скорость реакции зависит от факторов :
Природа реагирующих веществ;
Температура;
Концентрация реагирующих веществ;
Действие катализаторов;
Поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).

ВЫВОДЫ ПО ТЕМЕ УРОКА
Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции. Чем меньше энергия активации, тем больше эффективных соударений реагирующих частиц.
При увеличении температуры на 10º С общее число активных соударений увеличивается в 2-4 раза.
Чем больше концентрации реагентов, тем больше соударений реагирующих частиц, а среди них и эффективных соударений.
Катализатор изменяет механизм реакции и направляет её по энергетически более выгодному пути с меньшей энергией активации. Ингибитор замедляет ход реакции.
Гетерогенные реакции протекают на поверхности соприкосновения реагирующих веществ. Нарушение правильной структуры кристаллической решётки приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на «гладкой» поверхности.